由于新药专利合法地排除了竞争,其定价往往很高,影响到药物的可及性,从而与一国保障其公民健康权存在一定程度的冲突。相对于新药,仿制药品的上市风险小、投入成本低,可以为患者提供更多的药品选择性,仿制药进入市场后药品的价格会显著降低。
如何平衡专利权人与公共健康之间的利益冲突,使得既保障药物创新的积极性,同时又能最大限度的降低公民的药品支出,成为在制度设计上需要充分考虑的问题。这其中,最为重要的是如何建立一种高效的药品行政管理与专利的链接制度,推动仿制药商挑战药品专利权人的专利有效性,从而促进专利药尽快进入仿制竞争阶段。
根据《深化改革鼓励创新的意见》的文字表述以及CFDA①相关负责人的解释,我国建立药品专利链接制度的目的在于:鼓励医药产业的创新发展,提高药品的可及性。其中所鼓励的创新不仅是原始创新(对原研药②的研发),还包括消化吸收再创新(对仿制药的研发)。
实际上,促进药物研发创新和提高药品的可及性也是其他国家实施药品专利链接相关制度的目的。例如,美国Hatch—Waxman法案的两个立法目的就在于鼓励药物研发的创新和帮助仿制药更快地进入市场。而自该法案 1984年实施以来,减少了仿制药上市后的专利侵权纠纷,支持了创新药物研发;促进了仿制药的上市,提高了药品的可及性,实现了较好的经济效益和社会效益。
当今世界各国的药品专利链接制度都是以美国的制度为模板再根据本国国情和实践进行修改,因此本文介绍以美国的药品专利链接制度为例。这一制度的主要内容是,当申请上市的仿制药可能侵犯原研药专利从而存在专利侵权纠纷,且专利权人诉至法院的情况下,FDA将终止审批程序一段时间,直到专利纠纷得以解决或中止期届满。主要包括以下制度:美国食品药品监督管理局(FDA)将所有与NDA同时提交的有效专利的信息录入到《经治疗等同性评价标准的药品》,又称为桔皮书,录入桔皮书的专利称为登记专利。针对桔皮书所列专利,仿制药申请人需要作出以下四类声明之一:I桔皮书中没有相关专利;Ⅱ桔皮书所列专利保护器已届满;Ⅲ在桔皮书所列专利保护期届满前仿制药不会上市;Ⅳ(也称“专利挑战”)桔皮书所列的专利无效、不可实施或者生产商是仿制药不会侵犯专利权。对于列入桔皮书中的专利,如果仿制药申请人提出了第Ⅳ段专利声明,则只要专利权人在法定期限内提起专利侵权诉讼,即可以自动获得最长达30个月的仿制药审批“停摆期”。仿制药企业提交第IV段申明获胜后,拥有180天的市场独占期。该180天的市场独占期从仿制药上市的第一天起算。在此180天市场独占期期间,FDA不再批准相同的ANDA上市。仿制药在此期间可以以新药价格的约80%定价销售,并尽快占领仿制药市场。
在药品专利链接制度方面,美国最为完善,美国于1984年通过Hatch-Waxman法案,在全球首次建立了药品专利链接制度。美国专利链接制度包括桔皮书制度、专利声明和挑战、审批停摆期以及首仿药市场独占期制度。专利挑战和“停摆期”制度构成美国药品专利链接制度的核心基础。在2003年通过《处方药和医疗保险促进现代化法案》(MMA法案)对其进行了进一步完善。美国的药品专利和行政管理制度之间的链接理顺了药品专利权人和仿制药厂的关系,有效平衡了多方利益,大大促进了仿制药的及时上市。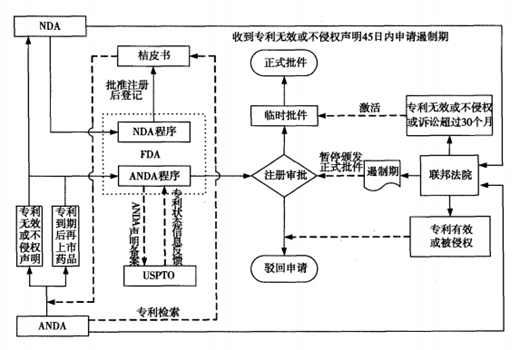
1993年,为限制涉及新药专利的仿制药在专利到期前上市,从而侵犯新药厂商的利益,加拿大参考美国专利链接制度制定了《药品(NOC)专利链接的管理办法》(NOC Regulations),并在加拿大卫生部设置了专利药品及联络办公室负责药品注册过程中的专利链接工作。经过2006年和2011年两次修正后整个体系已非常完善。与美国相比,加拿大的药品专利链接制度更侧重于加快仿制药的上市,一方面,在新药专利登记时,新药的专利要想登记在药品专利目录上,专利权人需要在提交新药上市申请时同时提出,或者在专利批准30日内提出。一旦被发现不符合登记的要件,卫生部的相关机构可以进行删除处理。另一方面,在处理专利纠纷时,加拿大只规定了24个月,因为加拿大的药品市场不同于美国的创新药多,研发新药能力强,加拿大则更需要保护仿制药的利益。
需要注意的是,美国和加拿大的药品专利链接仅仅是激活专利诉讼,并不涉及对专利有效性和专利侵权的实质审查。两个国家的药品注册管理部门从未对专利链接中的专利纠纷做出法律意义上的判决。韩国与美国于2010年签订了自由贸易协定,该协定于2012年3月15日生效。韩美自贸协定生效后,韩国即开始实施其中规定的专利信息公示和仿制药声明制度,但直到2015年3月15日才全面实施专利链接制度。韩国专利链接制度基本上以美国制度作为模板设计,但其依据自身医药产业发展水平和本国相关法律制度特点,并吸收了美国专利链接制度在实践过程中的经验和教训,作出了许多独特的设计。总的来说,韩国专利链接制度更偏向于对仿制药企业利益的保护,也更致力于提高药品可及性。欧洲和日本虽然没有建立专门的药品专利链接制度,但日本注重对专利权人的保护,除了有药品专利期补偿与试验数据保护制度外,为了解决仿制药上市可能带来的专利纠纷,规定在新药活性成分专利届满前,仿制药不能申请上市。欧洲有法定试验豁免例外,其认为药品专利链接制度与法定试验豁免相冲突,试验豁免制度是给予仿制药企业在原研药专利到期前,收集仿制药上市审批需要的数据,进入上市审批,等原研药专利期期满即可马上上市。同时为了避免对仿制药企业的过度保护,还有专利期补偿、试验数据保护相关配套制度,以平衡仿制药企业与专利权人利益。
2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,该文件是深化药品医疗器械审评审批制度改革的重要的纲领性文件。其中第十六项明确提出要“探索建立药品专利链接制度”。该文件中明确规定了药品专利链接的相关程序、义务、期限以及药品审评机构如何参考专利侵权纠纷的解决结果等内容。我国目前创新药虽然已取得了很大的进步,但与欧美等国家和地区相比仍然有不小的差距,而且仍然面临较严重的药品可及性问题,可以在美国的制度基础上具体细节更多的借鉴韩国经验。1.限制登记专利的药品范围和专利类型,尤其应当区分登记专利的药品和进入专利链接审查的药品。登记专利的药品范围应当限于在药品安全性和有效性方面创新的药品。根据2015年的数据统计,我国仿制药占比达到96%,如果我国不限制登记专利的药品范围,可能会带来以下影响:仿制药也进行专利登记导致登记专利的信息量剧增,同时仿制药申请人之间的专利纠纷也进入专利链接审查程序。美国专利链接相关制度在其实施过程中,也出现过原研药厂商滥用登记专利和遏制期来阻碍仿制药上市的例子。著名的GSK v.Apotex案件中,原研药厂商 GSK依据不同的专利对仿制药申请人Apotex提起5个专利侵权诉讼,这几个诉讼都获得了30 个月的停止审查期间,最后延缓仿制药上市长达 65 个月。注意到上述现象后,Hatch—Waxman法案经过修订,逐步明确了专利登记的条件(包括可登记的专利和明确禁止登记的专利 )、专利登记的内容 和方式、专利登记的时间等。在美国,根据FTC2002年统计,第IV段专利挑战相关专利诉讼的审理时间平均约为25个月。也就是说,即使专利权人在侵权诉讼中败诉,在这一期间其仍能保持其市场独占地位,从而获得远高于其诉讼成本的高额利润。这也就使得即便针对药物使用方法专利和药物产品专利的挑战成功率高达81%和97%,原研药企业仍然有足够的动机将这些专利列入桔皮书中,并提起专利链接制度下的侵权诉讼。韩国停摆期仅有9个月,远短于美国的30个月,也短于加拿大的24个月。韩国停摆期的法律效力是禁止仿制药企业上市其仿制药,而非如同美国那样禁止仿制药申请获得审批。与美国专利权人起诉能自动获得停摆期不同,韩国需要MFDS③进行审查后才能给予停摆期。通过这些设计,韩国专利链接制度能更加有效地避免专利权人对制度的滥用。而根据我国国情,仍是以仿制药占据市场,借鉴韩国的经验更为合适,但我国由于幅员辽阔,情况更为复杂,还需进一步的探究。“反向支付和解”是原研药企业滥用专利链接制度的一种形式,其本质是原研药企业和仿制药企业以协议的形式共同分享推迟仿制药上市时间所带来的垄断利益,将对仿制药市场竞争造成损害,也给药物可及性带来不利影响。在我国将来的药品专利链接制度实践中,可以预见也同样会出现“反向支付和解”的可能,对此需要提前在制度设计中加以规制。(关于反向支付的相关问题笔者曾探讨过,点击题名可跳转阅读:《智汇研究所:药物专利领域的反向支付问题研究》)韩国为避免首仿药市场独占期的滥用,韩国《药事法》规定了将导致首仿药市场独占期终止的情形,例如仿制药申请人获得的宣告专利无效或不落入专利保护范围的决定被撤销或被推翻等。我国仿制药企业较多,药品的质量也高低不同,在加强审评审批监管仿制药质量的同时,给予首仿药奖励,有助于激励创新,保障药品高质量。但需要对此进行一定的限制。比如,仿制药企业提交申请后,规定时间内没有获得上市批准的、仿制药申请人撤回申请、仿制药申请人与原研药专利权人达成协议的,取消对首仿药的奖励。5.药品监管部门、知识产权局和法院之间建立职能链接一是要在药品监管部门与知识产权局之间建立有效的链接。药品既是在药品管理制度下申请上市销售的客体,也是在专利制度下申请专利法保护的客体。《专利法》第75条第5项规定:有下列情形之一的,不视为侵犯专利权 :“为提供行政审批所需要的信息,制造、使用、进口专利药品或者专利医疗器械的,以及专门为其制造、进口专利药品或者专利医疗器械的。”据此能看到目前我国在药品标准和专利有一个基础链接,制药企业最好先申请专利,再申请药品注册,即药品专利是药品标准的基础,药品标准是药品专利的目的。二是药品监管部门与法院之间建立链接。仿制药申请人提出专利挑战的,专利权人认为其侵犯自己的权利,可以给予其诉讼期,向人民法院提起诉讼。
药品专利链接制度为药品专利权人提供了在药品上市前解决专利纠纷的途径,是社会纠纷解决机制得以实现的手段之一。该制度符合我国的知识产权政策立场和建设创新型国家的政策目标。药品专利链接制度的价值体现在行为规范价值和主体激励价值。该制度有助于强化药品专利权的保护,激励药品创新;有利于促进仿制药与创新药的充分竞争,实现医药产业的良性发展;有助于解决公民健康需求与药品供给不足的矛盾。该制度所要实现的终极价值目标在于通过强化药品专利权的保护,有效激励新药的研发,促进仿制药的上市,保障药品的可及性。因此,药品专利链接制度是解决我国药品专利保护不力、医药产业创新不足和高质量药品紧缺问题的重要途径,是落实国家医药产业创新发展与深化审评审批制度改革鼓励药品创新政策的重要制度设计。
①CFDA:指国家食品药品监督管理总局,是原中华人民共和国国务院食品药品监督管理的原直属机构机构。前身为国家食品药品监督管理局。
②原研药:即指原创性的新药,经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制。在我国,“原研药”主要是指过了专利保护期的进口药。
③MFDS:韩国食品药品管理局(Ministry of Food and Drug Safety,MFDS)前身为韩国食品药品监督管理局,它负责食品,药品,医疗器械和化妆品的安全性,食品和制药工业发展,以及促进公众健康的政府机构。韩国食品药品管理局旨在评估和提高食品安全,对食品添加剂,药品,化妆品,医疗器械和辐射,毒理学安全性进行监督。
[1]林玉红:《国家药品标准与药品专利链接关系简要分析》[2]王晓琳,李剑:《中国药品专利链接相关制度的专利法问题》[3]俞风雷:《知识产权保护中的利益平衡理论及其制度构建——以我国药品专利链接制度为例》[4]耿文军,丁锦希:《影响药品专利链接制度的重要因素和解决路径》[6]苏冬冬:《药品专利链接制度的正当性及制度性价值分析》[8]邱福恩:《美国药品专利链接制度实践情况及其启示》[9]邱福恩:《韩国药品专利链接制度介绍及对我国制度的启示》[10]刘立春,朱雪忠:《美国和加拿大药品专利链接体系要素的选择及其对中国的启示》[11]张浩然:《竞争视野下中国药品专利链接制度的继受与调适》





